 Production
de la protéine de fusion.
Production
de la protéine de fusion.
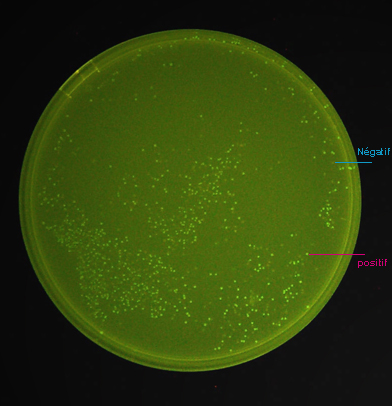 |
Cette
photo (ci-contre), d'un milieu sélectif solide sur lequel a été
étalé un mélange de bactéries transformées
avec les construction pGEX4T1-GFPuv, montre qu'en absence d'induction,
la protéine de fusion GST-GFPuv est synthétisée en
quantité suffisante pour pouvoir être détectée.
Il est même possible de séparer
les clones fluorescents ayant intégré l'insert avec la bonne
orientation, des clones non fluorescents ayant intégré l'insert
avec la mauvaise orientation ou n'ayant pas synthétisé suffisamment
de protéine pour être fluorescents
|
Un des clones bactérien ayant
intégré la bonne construction pGEX4T1-GFPuv est mis en culture
sur milieu sélectif liquide. Lorsque cette culture est en début
de phase exponentielle de croissance, la synthèse de la protéine
de fusion est induite massivement par ajout d'IPTG (Isopropyl-b-D-Thiogalactopyranoside).
Cet analogue structural du lactose induit l'opéron lactose (promoteur
Ptac). Après incubation, les bactéries sont détruites
et les protéines sont séparées des autres constituants
cellulaires.
(L'extrait protéique brut
sera soumis à plusieurs traitements successifs : élimination
des contaminants nucléotidiques, chromatographie d'affinité
puis décrochage par compétition avec du glutathion réduit
ou coupure à la thrombine. Un contrôle supplémentaire
est ajouté : un clone bactérien possédant le plasmide
pGEX4T1 vide subit le même traitement afin d'obtenir la protéine
GST seule.)
 Purification
de la protéine chimère.
Purification
de la protéine chimère.
L'extrait protéique
brut est mélangé à une suspension de billes d'agarose
couplées au Glutathion. La partie GST de la protéine de fusion
se fixe à son substrat (le glutathion) mais est incapable de le
métaboliser. Le complexe ainsi formé (Billes-Glutathion-GST-GFPuv)
peut être facilement séparé du reste des protéines
solubles par simple centrifugation à faible vitesse. Après
quelques lavages, ce complexe peut être rompu soit par compétition
(en ajoutant une dose massive de Glutathion réduit) soit par action
de la thrombine. En effet, le plasmide pGEX4T1 introduit un site de clivage
protéique par la thrombine au niveau de son site multiple de clonage.
Cette construction permet de séparer les deux protéines GST
et GFPuv.
 Recettes
et astuces
Recettes
et astuces L'ajout de Glutathion réduit
provoque un déplacement de l'équilibre enzyme-substrat par
compétition. En effet la protéine de fusion peut alors se
fixer soit sur le Glutathion lié aux billes d'agarose soit au Glutathion
réduit libre. Lorsque le Glutathion réduit est ajouté
en large excès, cet équilibre est totalement déplacé
vers le décrochage de la protéine de fusion des billes d'agarose.
Une centrifugation à faible vitesse permet de séparer le
culot de billes du surnageant contenant la protéine de fusion en
suspension.
Élution par clivage protéolytique
L'action de la thrombine pendant
30 minutes à 37°C sur le complexe billes-Glutathion-GST-GFPuv
sépare la partie GFPuv du reste du complexe (Billes-Glutathion-GST).
Une centrifugation permet de séparer le culot du surnageant qui
contient la GFPuv libre.
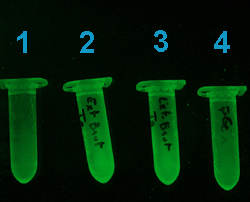 |
Cette photographie (ci-contre),
correspond à l'étape de lavage des billes d'agarose avec
la protéine de fusion fixée dessus. Le tube 1 ne contient
que les billes, sans protéine. Les tubes 2 et 3 contiennent les
billes et les protéines de deux clones bactériens positifs
(contenant le plasmide pGEX4T1-GFPuv correctement orienté). Le tube
4 contient les billes d'agarose Glutathion ainsi que l'extrait protéique
d'un clone bactérien transformé avec pGEX4T1 vide.
Une fluorescence importante est
visible dans les tubes 2 et 3.
La faible fluorescence des tubes
1 et 4 est imputable au plastique. |
Résultats
Après dosage des protéines
de chaque fraction, la même quantité de protéines est
déposée sur des gel d'acrylamide (à 10%) "natifs"
(sans SDS) afin d'en séparer les constituants protéiques
sans les dénaturer de façon trop irréversible. Après
migration, ce gel est observé sous lampe UV pour identifier les
bandes fluorescentes. Puis ce même gel est coloré au Bleu
de Coomassie afin de révéler toutes les bandes protéiques.
Les deux images , fluorescence (ci-dessous à gauche) et coloration
(ci-dessous à droite), sont comparées et interprétées
ci-dessous.
 Recettes
et astuces
Recettes
et astuces
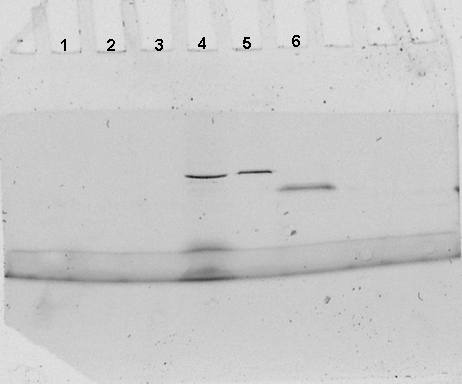
Obervation sous une lampe UV : fluorescence.
|
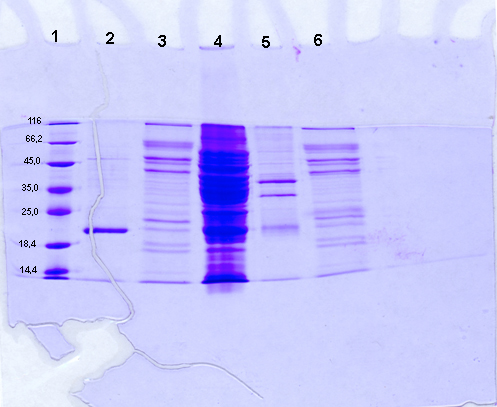 Observation après coloration des protéines : Bleu
de Coomassie
Observation après coloration des protéines : Bleu
de Coomassie
|
Piste 1 : Marqueur de taille. Piste
2 : Extrait protéique du clone bactérien transformé
par pGEX4T1 vide, élué par compétition des billes
d'agarose. Piste 3 : Extrait protéique du clone bactérien
transformé par pGEX4T1 vide et décroché par clivage
à la thrombine. Piste 4 : extrait protéique brut du clone
bactérien transformé avec pGEX4T11-GFPuv. Piste 5 : extrait
protéique du clone bactérien transformé avec pGEX4T11-GFPuv,
élué par compétition des billes d'agarose. Piste 6
: extrait protéique du clone bactérien transformé
avec pGEX4T11-GFPuv, décroché par clivage à la Thrombine.
 Le décrochage par compétition de la GST seule (piste 2) fait
apparaître sur le gel natif une bande non fluorescente d'environ
20 kDa. L'action de la thrombine (piste 3) laisse de nombreuse bandes non
fluorescentes de tailles variables. Il s'agit d'artefacts imputables à
la pureté de la thrombine commerciale. Cette piste servira de contrôle
négatif de migration pour la thrombine. Parmi les nombreuses bandes
présentes dans l'extrait brut (piste 4), une seule protéine
d'environ 40 kDa est fluorescente. Après purification par décrochage
compétitif (piste 5), il reste encore plusieurs bandes protéiques
dont une seule est fluorescente ; sa taille est identique à celle
observée en piste 4, mais son intensité est supérieure
(pour la même quantité globale de protéine déposée,
la proportion de protéine fluorescente est supérieure). Les
différentes protéines révélées sur la
piste 5 correspondent à des contaminants ayant une affinité
pour les billes d'agarose ou le complexe billes-Glutathion-GST-GFPuv, ou
bien qui ont été coprécipité au cours des centrifugations.
Après décrochage à la thrombine (piste 6), le profil
protéique est très proche de celui observé en piste
3. Cependant une bande contenant très peu de protéine (puisque
difficile à distinguer après coloration), est très
fortement fluorescente. Cette bande d'environ 25kDa correspond à
la GFPuv seule. Il est à remarquer que l'intensité lumineuse
de la GFPuv seule est supérieure à celle de la GST-GFPuv.
En effet, pour une masse moindre de protéine, la fluorescente est
beaucoup plus intense.
Le décrochage par compétition de la GST seule (piste 2) fait
apparaître sur le gel natif une bande non fluorescente d'environ
20 kDa. L'action de la thrombine (piste 3) laisse de nombreuse bandes non
fluorescentes de tailles variables. Il s'agit d'artefacts imputables à
la pureté de la thrombine commerciale. Cette piste servira de contrôle
négatif de migration pour la thrombine. Parmi les nombreuses bandes
présentes dans l'extrait brut (piste 4), une seule protéine
d'environ 40 kDa est fluorescente. Après purification par décrochage
compétitif (piste 5), il reste encore plusieurs bandes protéiques
dont une seule est fluorescente ; sa taille est identique à celle
observée en piste 4, mais son intensité est supérieure
(pour la même quantité globale de protéine déposée,
la proportion de protéine fluorescente est supérieure). Les
différentes protéines révélées sur la
piste 5 correspondent à des contaminants ayant une affinité
pour les billes d'agarose ou le complexe billes-Glutathion-GST-GFPuv, ou
bien qui ont été coprécipité au cours des centrifugations.
Après décrochage à la thrombine (piste 6), le profil
protéique est très proche de celui observé en piste
3. Cependant une bande contenant très peu de protéine (puisque
difficile à distinguer après coloration), est très
fortement fluorescente. Cette bande d'environ 25kDa correspond à
la GFPuv seule. Il est à remarquer que l'intensité lumineuse
de la GFPuv seule est supérieure à celle de la GST-GFPuv.
En effet, pour une masse moindre de protéine, la fluorescente est
beaucoup plus intense.
 6
6
[accueil] [principe
de la PCR] [recherche par thème]
[FAQ] [Glossaire]
[Liens spécifiques GFP] [Liens
externes]



