Publication du laboratoire de chimie
ou quand l’infiniment petit et l’infiniment court éclairent le mécanisme de la vision
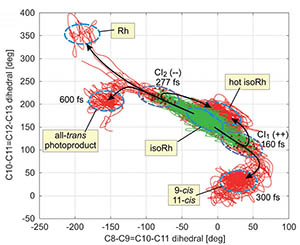
Overlay of the 81 computed isoRh trajectories from FC to the different molecular outcomes as a function of the C9=C10 and the C11=C12 dihedral twist with average reaction times and final configurations. The paths turn from green to red with the excited to ground state surface hop at one of the two CIs.La vision est certainement le sens le plus efficace pour être en contact avec le monde qui nous entoure. L’œil, cet organe commun à tant d’êtres vivants, est tapissé d’une rétine équipée de minuscules cônes. Ceux-ci contiennent une protéine appelée rhodopsine qui renferme la molécule de la vision : le rétinal. Le rétinal possède des doubles liaisons C=C dont une en 9e position et une en 11e position. Cette dernière s’inverse quand elle absorbe un photon, ce qui informe le cerveau (c’est la vision).
Cette inversion dure 200 femtosecondes (200 fs = 200.10–12 s, soit le temps que met la lumière pour parcourir seulement 6 cm !). C’est la réaction chimique la plus rapide qui ait jamais été étudiée. Il a été établi que cette inversion de la double liaison 11 (en rouge figure 1) n’est pas un retournement comme la figure le représente. Cela nécessiterait plus de place que ce que la cavité de la protéine n’en dispose et prendrait plus longtemps que 200 fs. Le mécanisme du pédalage (figure 2), où deux atomes de carbone décrivent de petits cercles, nécessite peu de place est peut se faire rapidement.
![[title-image]1332154750685[/title-image] proteine-spectroscopie-fig-1_1395231905629-jpg](https://www.ens-lyon.fr/sites/default/files/ksup/proteine-spectroscopie-fig-1_1395231905629.jpg) Cette histoire de l’infiniment petit et de l’infiniment court est un peu plus compliquée que cette description car la double liaison en 9e position peut aussi s’inverser et donner l’isorhodopsine. Son influence sur l’évolution du rétinal, lorsqu’il absorbe un photon, a été très étudiée et une équipe du laboratoire de chimie de l’École normale supérieure de Lyon en collaboration avec l’École polytechnique de Milan, l’Université de Bologne (Italie) l’Heinrich-Heine-Universität de Düsseldorf (Allemagne), les universités d’Oxford, de Liverpool (Angleterre) et de Berkeley (USA) vient de proposer un mécanisme qui rend compte des nombreuses données sur ce sujet. On sait maintenant que l’isorhodopsine met trois fois plus de temps pour s’inverser que la rhodopsine, que son pédalage ne peut se faire que dans un seul sens car la protétine le bloque dans l’autre sens, et que l’isorhodopsine a deux chemins possibles pour s’inverser dont l’un est une impasse.
Cette histoire de l’infiniment petit et de l’infiniment court est un peu plus compliquée que cette description car la double liaison en 9e position peut aussi s’inverser et donner l’isorhodopsine. Son influence sur l’évolution du rétinal, lorsqu’il absorbe un photon, a été très étudiée et une équipe du laboratoire de chimie de l’École normale supérieure de Lyon en collaboration avec l’École polytechnique de Milan, l’Université de Bologne (Italie) l’Heinrich-Heine-Universität de Düsseldorf (Allemagne), les universités d’Oxford, de Liverpool (Angleterre) et de Berkeley (USA) vient de proposer un mécanisme qui rend compte des nombreuses données sur ce sujet. On sait maintenant que l’isorhodopsine met trois fois plus de temps pour s’inverser que la rhodopsine, que son pédalage ne peut se faire que dans un seul sens car la protétine le bloque dans l’autre sens, et que l’isorhodopsine a deux chemins possibles pour s’inverser dont l’un est une impasse.![[title-image]1332154750683[/title-image] proteine-spectroscopie-fig-2_1395231677644-jpg](https://www.ens-lyon.fr/sites/default/files/ksup/proteine-spectroscopie-fig-2_1395231677644.jpg) Pour trouver ces résultats, ces chercheurs ont croisé des mesures à partir de rhodopsine extraite d’un œil de bœuf et étudié son comportement par des techniques de lasers ultrarapides. Une résolution de 10 fs a été nécessaire ! Ces observations ont été croisées avec des calculs hybrides de mécanique quantique et de modélisation moléculaire. De nombreuses trajectoires des atomes concernées par le mécanisme de la vision ont été ainsi déterminées et sont représentées sur le graphe ci-dessous. Ce graphe montre les possibilités de passage de l’isorhodopsine à la rhodopsine et au rétinal inversé (all-trans-photoproduct), ainsi que la durée des transformations.
Pour trouver ces résultats, ces chercheurs ont croisé des mesures à partir de rhodopsine extraite d’un œil de bœuf et étudié son comportement par des techniques de lasers ultrarapides. Une résolution de 10 fs a été nécessaire ! Ces observations ont été croisées avec des calculs hybrides de mécanique quantique et de modélisation moléculaire. De nombreuses trajectoires des atomes concernées par le mécanisme de la vision ont été ainsi déterminées et sont représentées sur le graphe ci-dessous. Ce graphe montre les possibilités de passage de l’isorhodopsine à la rhodopsine et au rétinal inversé (all-trans-photoproduct), ainsi que la durée des transformations.Références : Wavepacket Splitting and Two-Pathway Deactivation in the Photoexcited Visual Pigment Isorhodopsin. Dario Polli, Oliver Weingart, Daniele Brida, Emiliano Poli, Margherita Maiuri, Katelyn M. Spillane, Andrea Bottoni, Philipp Kukura, Richard A. Mathies, Giulio Cerullo, et Marco Garavelli. Angew. Chem. Int. Ed.2014, 53, (page non encore connues)