Contribution du LJC dans Cancer Cell
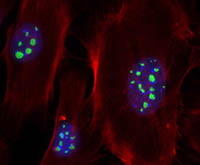
Localisation de la fibrillarine (vert) dans les nucléoles de cellules NIH3T3. Photo F. Catez (CRCL)
L’équipe de Philippe Bouvet du Laboratoire Joliot-Curie (LJC), USR CNRS 3010, a participé a une étude majeure sur le rôle de p53 dans la régulation d'une protéine qui modifie qualitativement et fonctionnellement les ribosomes dans les cancers du sein et du colon. Cette étude qui vient d’être publiée dans la prestigieuse revue Cancer Cell, a fait l'objet d'un communiqué de presse.
Il est maintenant clairement démontré que la production de ribosome est sur-activée dans les cellules cancéreuse et que cette sur-activation joue un rôle clé dans la progression tumorale. De plus, il a été montré récemment que le ciblage de la production de ribosome représente une approche inattendue, mais efficace pour le développement de molécules anti-cancer hautement spécifiques. Les ribosomes sont des machineries cellulaires complexes qui participent directement à la régulation de l’expression génique, notamment par l’intermédiaire de leurs ARN qui sont considérés comme des ribozymes. Cette activité est optimisée par des modifications post-transcriptionnelles, telle que la méthylation en 2’ du ribose de l’ARN qui est catalysée par la methyl-transférase fibrillarine (FBL) et guidée par une famille de petits ARN nucléolaires anti-sens.
![[title-image]1332154747163[/title-image] ribosome-normal-vs-malade-200px_1379602372078-jpg](https://www.ens-lyon.fr/sites/default/files/ksup/ribosome-normal-vs-malade-200px_1379602372078.jpg) L'équipe du LJC a participé aux travaux menés par l'équipe de Jean-Jacques Diaz du Centre de Recherche sur le Cancer de Lyon (CRCL) qui vient de démontrer que p53 réprime l’expression de la FBL et que des niveaux élevés de FBL sont accompagnés par des modifications des patrons de méthylation de l’ARN ribosomique avec une augmentation à la fois des erreurs de traduction et de l’efficacité d’initiation de la traduction d’ARN messagers codant pour des protéines clés du cancer et contenant des IRES (Internal Ribosome Entry Site). De plus, la surexpression de la FBL contribue à la tumorigenèse et est associée à un mauvais pronostic pour les patientes atteintes de cancer du sein. En démontrant que p53 régule la biogenèse et l’activité intrinsèque des ribosomes, cette étude révèle que l’inactivation de p53 participe à la « reprogrammation traductionnelle » qui prend place dans les cellules cancéreuses et contribue à l’expression incontrôlée d’oncogènes cruciaux au développement de la pathologie.
L'équipe du LJC a participé aux travaux menés par l'équipe de Jean-Jacques Diaz du Centre de Recherche sur le Cancer de Lyon (CRCL) qui vient de démontrer que p53 réprime l’expression de la FBL et que des niveaux élevés de FBL sont accompagnés par des modifications des patrons de méthylation de l’ARN ribosomique avec une augmentation à la fois des erreurs de traduction et de l’efficacité d’initiation de la traduction d’ARN messagers codant pour des protéines clés du cancer et contenant des IRES (Internal Ribosome Entry Site). De plus, la surexpression de la FBL contribue à la tumorigenèse et est associée à un mauvais pronostic pour les patientes atteintes de cancer du sein. En démontrant que p53 régule la biogenèse et l’activité intrinsèque des ribosomes, cette étude révèle que l’inactivation de p53 participe à la « reprogrammation traductionnelle » qui prend place dans les cellules cancéreuses et contribue à l’expression incontrôlée d’oncogènes cruciaux au développement de la pathologie.
Légende illustration : Modèle pour l’implication de p53 dans le contrôle de quantité et de la qualité des ribosomes et de la conséquence sur la traduction des protéines. Dans des cellules saines, p53 régule négativement l'activité de l’ARN polymerase I pour contrôler la quantité ribosome et régule aussi les niveaux d'expression de la fibrillarine (FBL) pour contrôler la qualité ribosome. FBL est une méthyl-transferase qui est responsable de la méthylation des ARN ribosomiques; ces modifications sont nécessaires pour assurer une traduction correcte des ribosomes dans une cellule normale. Dans les cellules exprimant une protéine p53 mutée ou non-fonctionnelle (cellule cancéreuse), la perte de répression de l'activité ARN pol I conduit à une augmentation de la synthèse de l'ARN ribosomique (et une augmentation de ribosome) et en parallèle, l'inactivation de p53 conduit à une augmentation des niveaux d'expression de FBL, entraînant une modification des profils de méthylation de l’ARN ribosomique. Les ribosomes avec des ARN ribosomiques méthylés modifiés traduisent les ARNm avec une fidélité plus faible (non reconnaissance du codon stop, mis-incorporation d'acide aminé) et sont plus susceptibles d'initier la traduction d'ARNm qui comportent des IRES et qui codent pour des protéines pro-oncogènes, anti-apoptotiques et de survie.
Sources : Cancer Cell (Volume 24, Issue 3, 318-330, 9 September 2013)