Publication du laboratoire de Chimie
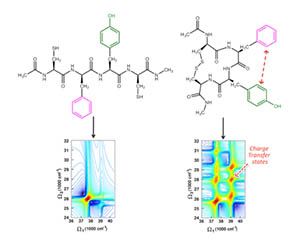
Spectre UV à deux dimensions correspondant à chacune des deux formes de la chaîne protéique.
Connaitre avec précision la forme des protéines est essentiel pour les biologistes car ces molécules sont à l’origine de nombreuses maladies, gèrent le métabolisme des organismes, etc. Des méthodes existent déjà, par exemple avec des rayons X, par résonnance magnétique nucléaire à deux dimensions, ou par spectroscopie infrarouge à deux dimensions (2DIR). Cependant, ces méthodes sont soit longues à mettre en œuvre (RX, RMN), soit elles n’informent pas sur la forme des protéines avec assez de détails (2DIR). Les spectroscopistes se sont récemment tournés vers la spectroscopie ultraviolet à deux dimensions (2DUV), cependant, les méthodes de calcul qui permettent d’interpréter les spectres obtenues n’exploitaient pas suffisamment les données pour être efficaces. Des chercheurs du laboratoire de chimie de l’École normale supérieure de Lyon en collaboration avec des chercheurs des universités de Bologne (Italie), de Milan (Italie) et de Californie (UC-Irvine, USA) sont parvenus à mettre au point de nouvelles méthodes de calculs qui utilisent toute la richesse des données résultant des spectres 2DUV. Ce travail propose un guide pour mener à bien des spectres 2DUV des polypeptides.
Le tétrapetide modèle qui a permis de mettre au point ces nouvelles méthodes de calculs peut avoir ses chaînes latérales distante ou voisine. Les noyaux aromatiques des aminoacides phénylalanine, tyrosine et tryptophane de ces chaînes servent de sondes absorbant dans l’UV. Le fait que ces acides aminés soient peu présents par rapport aux autres est un atout bien exploité par cette méthode qui fournit des informations structurales en solution, sans avoir recourt à des méthodes isotopiques.
Références : Artur Nenov, Ivan Rivalta, Giulio Cerullo, Shaul Mukamel, and Marco Garavelli. Disentangling Peptide Configurations via Two-Dimensional Electronic Spectroscopy: Ab Initio Simulations Beyond the Frenkel Exciton Hamiltonian. J. Phys. Chem. Lett., 2014, 5 (4), pp 767–771.
Connaitre avec précision la forme des protéines est essentiel pour les biologistes car ces molécules sont à l’origine de nombreuses maladies, gèrent le métabolisme des organismes, etc. Des méthodes existent déjà, par exemple avec des rayons X, par résonnance magnétique nucléaire à deux dimensions, ou par spectroscopie infrarouge à deux dimensions (2DIR). Cependant, ces méthodes sont soit longues à mettre en œuvre (RX, RMN), soit elles n’informent pas sur la forme des protéines avec assez de détails (2DIR). Les spectroscopistes se sont récemment tournés vers la spectroscopie ultraviolet à deux dimensions (2DUV), cependant, les méthodes de calcul qui permettent d’interpréter les spectres obtenues n’exploitaient pas suffisamment les données pour être efficaces. Des chercheurs du laboratoire de chimie de l’École normale supérieure de Lyon en collaboration avec des chercheurs des universités de Bologne (Italie), de Milan (Italie) et de Californie (UC-Irvine, USA) sont parvenus à mettre au point de nouvelles méthodes de calculs qui utilisent toute la richesse des données résultant des spectres 2DUV. Ce travail propose un guide pour mener à bien des spectres 2DUV des polypeptides.
Le tétrapetide modèle qui a permis de mettre au point ces nouvelles méthodes de calculs peut avoir ses chaînes latérales distante ou voisine. Les noyaux aromatiques des aminoacides phénylalanine, tyrosine et tryptophane de ces chaînes servent de sondes absorbant dans l’UV. Le fait que ces acides aminés soient peu présents par rapport aux autres est un atout bien exploité par cette méthode qui fournit des informations structurales en solution, sans avoir recourt à des méthodes isotopiques.
Références : Artur Nenov, Ivan Rivalta, Giulio Cerullo, Shaul Mukamel, and Marco Garavelli. Disentangling Peptide Configurations via Two-Dimensional Electronic Spectroscopy: Ab Initio Simulations Beyond the Frenkel Exciton Hamiltonian. J. Phys. Chem. Lett., 2014, 5 (4), pp 767–771.
Mots clés