
Publication des travaux de l'Institut de génomique fonctionnelle de Lyon dans la revue Cell Host Microbe.
Les symbioses facultatives entre animaux et micro-organismes jouent un rôle fondamental dans la santé des écosystèmes et des organismes. Toutefois, du fait de la nature flexible de ces associations, les pressions de sélection qui régissent ces symbioses restent peu connues. Une étude publiée le 28 Juin 2018 dans Cell Host and Microbe par l'équipe de François Leulier à l’Institut de Génomique Fonctionnelle de Lyon, utilisant le modèle expérimental de symbiose entre la drosophile et sa bactérie commensale Lactobacillus plantarum, met en évidence le rôle prépondérant de l'environnement nutritionnel comme premier facteur déterminant l'évolution de cette symbiose. Les chercheurs identifient la production d'acide-aminés N-acetylé comme le processus résultant de l'adaptation de la bactérie à ce nouvel environnement nutritionnel favorisant la performance de son hôte. Cette étude indique que l'adaptation bactérienne à la nutrition de son hôte, plutôt qu'à celui-ci directement, est une première étape importante dans l'évolution des symbioses facultatives bactéries-animaux.
Les symbioses entre animaux et bactéries sont ubiquitaires et leur nature très diverse. Par opposition aux interactions pathogéniques délétères pour l'hôte, les relations mutualistiques sont bénéfiques pour l'animal. Elles sont très répandues dans le règne vivant, en particulier les mutualismes facultatifs, où animaux et bactéries ne sont pas dépendant l'un de l'autre pour leur survie mais ces partenaires en association partagent des bénéfices cruciaux. Toutefois la nature très flexible de leurs interactions suggère un mélange complexe de coûts et bénéfices associés au maintien de cette symbiose. Ainsi les pressions de sélection qui gouvernent l'évolution des bénéfices conférés par les symbiontes facultatifs à leurs hôtes animaux restent largement incomprises.
L'équipe de François Leulier utilise l’interaction entre la drosophile et sa bactérie commensale Lactobacillus plantarum comme modèle expérimental de symbiose facultative et avait précédemment démontré que cette association est un prototype de mutualisme facultatif nutritionnel, où les deux partenaires bénéficient de leur association : la drosophile par l'optimisation de sa croissance juvénile et de sa digestion grâce à l'action du commensal et le commensal par l'action de composés sécrétés par la drosophile assurant leur meilleure persistance dans la niche nutritionnelle. Utilisant ce modèle expérimental, les chercheurs ont maintenant voulu définir quelles étaient les mécanismes guidant l'évolution de cette symbiose.
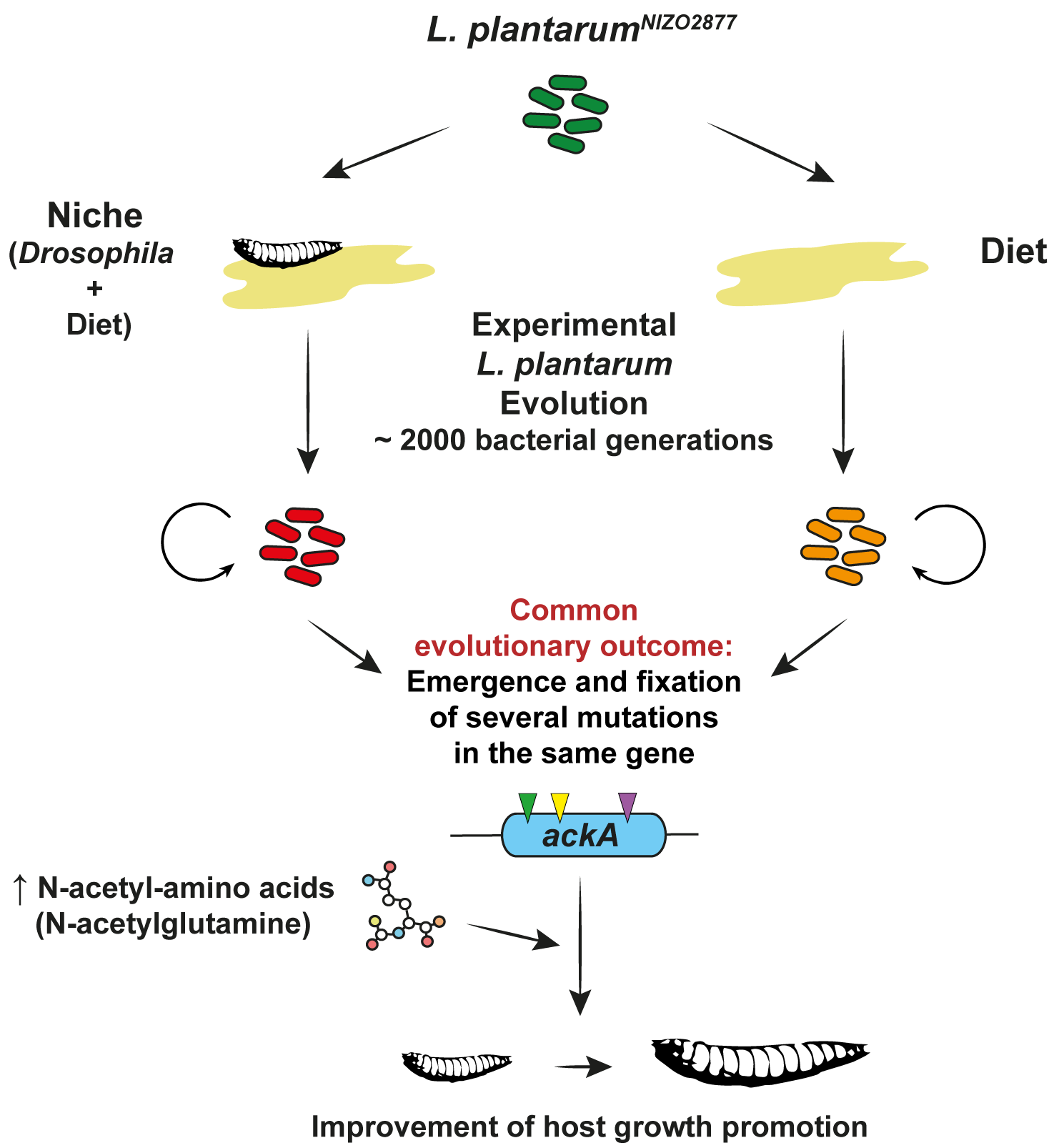
Pour aborder cette question les chercheurs ont appliqué une approche d'évolution expérimentale à une souche de Lactobacillus plantarum qui n'avait jamais été associée à la drosophile et qui présente une influence modérée sur la physiologie de celle-ci. Cette souche a donc été associée avec des larves de drosophiles axéniques puis seules les quelques premières drosophiles émergentes ont été sélectionnées comme fondatrice de la génération suivante, et ce pendant 20 générations. Au cours de ce protocole, les chercheurs ont identifié rapidement, de manière répétée et indépendante, des mutations dans le locus de l'acetate kinaseA (ackA) qui ont été rapidement fixées dans la population bactérienne. Cette mutation confère un avantage compétitif pour les souches porteuses de ces mutations par rapport à la souche ancestrale mais de manière inattendue ces mutations ont aussi été fixées dans des protocoles d'évolution expérimentale effectués en absence de la drosophile suggérant que la fixation de cette mutation est une adaptation bactérienne à l'environnement nutritionnel de la drosophile et non à une adaptation à la drosophile elle-même. Toutefois de manière inattendue les souches évoluées en absence de la drosophile et porteuse de mutations du locus ackA confèrent, lors de leur association à des larves axéniques de drosophile, un bénéfice bien plus fort que la souche ancestrale indiquant que cette adaptation à l'environnement nutritionnel par fixation de mutations au locus ackA est par ricochet bénéfique à la physiologie de la drosophile. Les chercheurs ont ensuite voulu identifier les bases mécanistiques de ce bénéfique accru et ont identifié que les mutations au locus ackA provoquent une augmentation de la production d'acides aminés N-acétylés par les bactéries évoluées; en particulier la N-acétyl-Glutamine, un composé dont les chercheurs ont démontré l'action bénéfique sur des larves associées à la souche ancestrale (non muté au locus ackA), expliquant ainsi l'effet bénéfique des souches évoluées.
L'évolution de la symbiose facultative entre la drosophile et son partenaire Lactobacillus plantarum est donc façonnée premièrement par l'environnement nutritionnel de l'hôte et l'adaptation rapide du symbionte à celui-ci. Ces résultats illustrent un exemple clair de mutualisme facultatif où la physiologie de l'hôte bénéficie d'un produit de l'adaptation génétique du symbionte à son nouvel environnement nutritionnel. Un mécanisme probablement conservé dans de multiples symbioses nutritionnelles dont celle que nous établissons avec nos communautés microbiennes intestinales suggérant ainsi que nous et nos symbiontes sommes façonnés par notre nutrition.
Source : Bacterial Adaptation to the Host's Diet Is a Key Evolutionary Force Shaping Drosophila-Lactobacillus Symbiosis. Martino, M.E., Joncour, P., Leenay, R., Gervais, H., Shah, M., Hughes, S., Gillet, B., Beisel, C., and Leulier, F. (2018). Cell Host Microbe 24. 28 juin 2018. DOI : 10.1016/j.chom.2018.06.001.
Disciplines
Mots clés






