
Publication du Laboratoire de Chimie dans la revue Nucleic Acids Research, le 16 mai 2023. Communiqué de presse du CNRS du 16 mai 2023.
Des scientifiques du CNRS, de l’ENS de Lyon, de l’Université d’Angers et de l’Université Claude Bernard Lyon 1, avec la participation d’institutions suédoises et sud-coréennes, ont mis au point une nouvelle molécule capable de s’accumuler spécifiquement dans les cellules cancéreuses, et de devenir toxique au contact de la lumière. En laboratoire, elle s’est montrée plus efficace que les traitements actuels de ce type, même utilisée à des concentrations beaucoup plus faibles. Ces résultats sont à paraître le 16 mai 2023 dans Nucleic Acids Research.
Utilisées principalement dans le traitement de certains cancers, les thérapies photodynamiques sont des traitements peu invasifs. Elles reposent sur l’utilisation de photosensibilisateurs, des molécules capables de s’exciter au contact de la lumière et de transmettre leur énergie au dioxygène contenu dans les cellules ciblées, le rendant toxique et provoquant la mort de ces dernières.
À travers une collaboration interdisciplinaire et internationale, des scientifiques du Laboratoire de chimie (CNRS/ENS de Lyon), du Building Blocks for Future Electronics Laboratory (CNRS/Sorbonne Université/Yonsei University) en Corée du Sud, du laboratoire Moltech-Anjou (CNRS/Université d’Angers) et leurs collègues sud coréens ont conçu un nouveau photosensibilisateur, appelé DBI. Cette molécule s’est révélée beaucoup plus efficace que les photosensibilisateurs employés dans les traitements actuels, permettant d’envisager une utilisation à des doses thérapeutiques 10 à 100 fois plus faibles. L’emploi du DBI pourrait ainsi minimiser les possibles effets indésirables sur les tissus sains. Cette efficacité a été caractérisée et testée in vitro sur des cellules humaines et in vivo sur des embryons de poissons zèbres par leurs collègues suédois.
Le DBI a été élaboré à partir d’un colorant initialement utilisé par l’industrie textile et produit annuellement à l’échelle de plusieurs tonnes. En modifiant chimiquement sa structure, les scientifiques lui ont conféré de nouvelles propriétés photosensibilisatrices. Par ailleurs, le DBI a également acquis, de par sa structure, la capacité d’interagir avec l’ADN contenu dans les exosomes, des composants surexprimés dans les cellules cancéreuses. Le photosensibilisateur s’accumule ainsi préférentiellement dans ces compartiments cellulaires clés des cellules cancéreuses, où le stress oxydatif généré par exposition à la lumière conduit à la dégradation de l’ADN et in fine à la mort de la cellule.
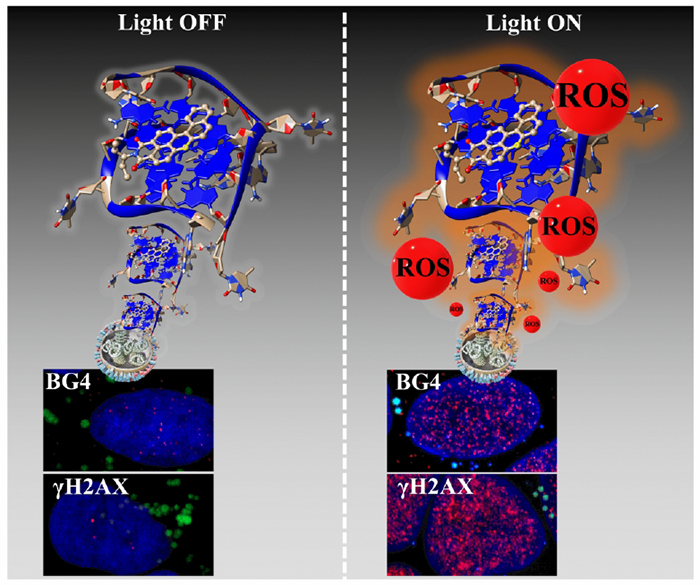
Sur la partie gauche de l’image (avant irradiation), le noyau cellulaire est marqué par un colorant fluorescent bleu, la localisation du photosensibilisateur apparaît sous forme de vésicules fluorescentes vertes. À droite (sous photo-irradiation), le photosensibilisateur génère des espèces réactives oxygénées (Reactive Oxygen Species ou ROS), extrêmement toxiques pour la cellule. Les zones affectées se présentent sous forme de points fluorescents rouges.
Au-dessus de ces images microscopiques figure une modélisation des complexes formés entre des séquences spécifiques ADN (télomères) et le photosensibilisateur.
© Sabouri et al. / Nucleic Acids Research
Référence : New G-quadruplex-specific photosensitizer inducing genome instability in cancer cells by triggering oxidative DNA damage and impeding replication fork progression. Marco Deiana, José María Andrès Castán, Pierre Josse, Abraha Kahsay, Darío Puchán Sánchez, Korentin Morice, Natacha Gillet, Ranjitha Ravindranath, Ankit Kumar Patel, Pallabi Sengupta, Ikenna Obi, Eva Rodriguez Marquez, Lhoussain Khrouz, Elise Dumont, Laura Abad Galán, Magali Allain, Bright Walker, Hyun S. Ahn, Olivier Maury, Philippe Blanchard, Tangui le Bahers, Daniel Öhlund, Jonas von Hofsten, Cyrille Monnereau, Clément Cabanetos, et Nasim Sabouri. Nucleic Acids Research, 16 mai 2023.
DOI : 10.1093/nar/gkad365
Dans les médias
- Les Échos, 16/05/2023, Une molécule sensible à la lumière pourrait permettre de détruire les cellules cancéreuses
- France Info, 16/05/2023, Lutte contre le cancer : une molécule, dérivée d'un colorant textile, s'attaque aux cellules cancéreuses
- Doctissimo, 17/05/2023, Cancer : une molécule dérivée d'un colorant textile offre de nouveaux espoirs
- Le Progrès, 19/05/2023, Des Lyonnais conçoivent une molécule capable de tuer les cellules cancéreuses grâce à la lumière
- Science&Vie, 19/05/2023, Des chercheurs inventent une nouvelle molécule "tueuse" de cancer … à l’aide de la lumière
- Europe 1, 22/05/2023, Lutte contre le cancer : des scientifiques misent sur une molécule dérivée d'un colorant textile
- The Conversation, 14/06/2023, Pourra-t-on un jour traiter des cancers avec des sous-produits de l’industrie textile ?
Structures
Disciplines
Mots clés






