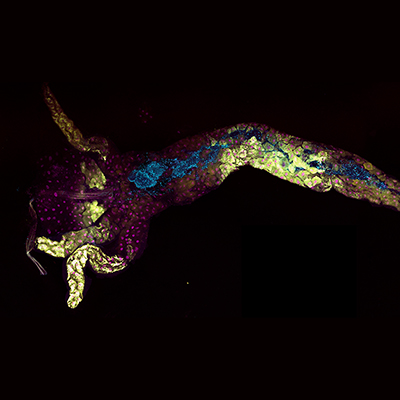
Publication de l'IGFL dans la revue eLife, le 9 juin 2023. Communication du 12 juillet 2023.
Dans la nature, tout est affaire de perception : c’est en connaissant leur environnement que les êtres vivants peuvent y réagir. Nos cellules sont notamment capables de percevoir la présence de bactéries à leur contact. Mais comment ? En utilisant la mouche du vinaigre - la drosophile - comme modèle, une équipe de recherche menée par l’Institut de Génomique Fonctionnelle de Lyon (IGFL, CNRS/ENS de Lyon) décrit un nouveau mécanisme grâce auquel les cellules de l’intestin peuvent "sentir" les bactéries du microbiote et s’y adapter. Cette étude est publiée dans eLife.
Nous vivons dans un monde de microbes. Les bactéries sont apparues bien avant les animaux et ont peuplé tous les environnements terrestres qui leur étaient accessibles, des lacs acides jusqu’à la banquise polaire en passant par l’intérieur de notre intestin. Il n’est donc pas étonnant que l’évolution nous ait doté de mécanismes moléculaires capables de percevoir la présence, la nature et l’abondance des bactéries au contact de nos cellules. Certains de ces mécanismes permettent à nos cellules de se défendre contre des pathogènes : par exemple, la protéine TLR-4 s’active dans nos cellules quand elle rencontre des lipopolysaccharides, des composants de la paroi des bactéries. Cela induit une réponse immunitaire qui permet à notre organisme de se défendre. Cependant, toutes les bactéries ne sont pas des pathogènes : certaines, comme celles de notre microbiote intestinal, s’inscrivent dans une relation de symbiose avec l’organisme hôte. Ces symbiontes sont donc bénéfiques à note santé. Alors qu’en est-il de ces "bonnes" bactéries ? Nos cellules sont-elles aussi capables de percevoir leur présence et de s’y adapter ?
Dans les années 2000, des travaux sur la mouche Drosophila melanogaster ont identifié certains des mécanismes moléculaires permettant aux cellules des animaux de percevoir la présence de bactéries pathogènes et de s’y adapter. Aujourd’hui, une équipe de chercheurs et de chercheuses du CNRS et de l’ENS de Lyon, en collaboration avec des scientifiques de l’INRAE a utilisé ce même organisme modèle pour identifier les mécanismes permettant aux cellules de l’hôte de percevoir la présence de certaines bactéries symbiotiques et de s’y adapter.
Les scientifiques se sont concentrés sur une espèce de bactérie symbiotique nommée Lactiplantibacillus plantarum. Ce lactobacille est notamment connu pour améliorer la croissance juvénile des drosophiles et des souris en situation de malnutrition. En utilisant des milieux nutritionnels chimiquement définis, les scientifiques ont montré que L. plantarum peut compenser la carence en certains acides aminés (les constituants des protéines), permettant aux larves de drosophiles de se développer quand ces acides aminés sont rares. Il était déjà connu que L. plantarum pouvait synthétiser certains acides aminés et les fournir à son hôte ; mais étonnement, les scientifiques ont observé que la bactérie pouvait également compenser la carence en d’autres acides aminés qu’elle est incapable de synthétiser.
Comment expliquer ce phénomène ? En utilisant des techniques de génétique chez l’hôte et chez la bactérie, les scientifiques ont mis en évidence deux facteurs clés : la production de petits ARN (ARN de transferts et ARN ribosomaux) par la bactérie et l’activation de la protéine GCN2 dans les cellules intestinales de l’hôte. La présence de L. plantarum active GCN2 dans certaines cellules de l’intestin. Cependant, des bactéries mutantes rendues incapables de produire ces petits ARN activent moins GCN2 et sont également moins bénéfiques pour leur hôte. Enfin des drosophiles dont on a "éteint" génétiquement GCN2 dans l’intestin ne bénéficient plus de la présence de L. plantarum.
Le modèle proposé par les scientifiques est le suivant : dans l’intestin de la drosophile, L. plantarum produit des petits ARN. Ces petits ARN arrivent jusqu’aux cellules de l’intestin, où est exprimée la protéine GCN2. Les petits ARN se lient alors à GCN2, ce qui active la protéine et provoque des changements physiologiques de l’intestin (croissance des cellules, changements métaboliques) conduisant à une meilleure absorption des nutriments, et compensant ainsi une carence en acides aminés.
Comme TLR-4 permet de sentir la présence de bactéries pathogènes et de lancer un programme de défense, GCN2 pourrait donc permettre de sentir la présence de bactéries symbiotiques à travers leurs petits ARN et de lancer un programme d’absorption des nutriments. Ce mécanisme serait fort utile aux drosophiles, dont les larves ne peuvent se développer que sur des fruits en décomposition, riches en microbes. Mais la protéine GCN2 est commune à tous les animaux, y compris les humains. Peut-être découvrirons-nous un jour que nous aussi "sentons" avec nos tripes les petits ARN de notre microbiote.
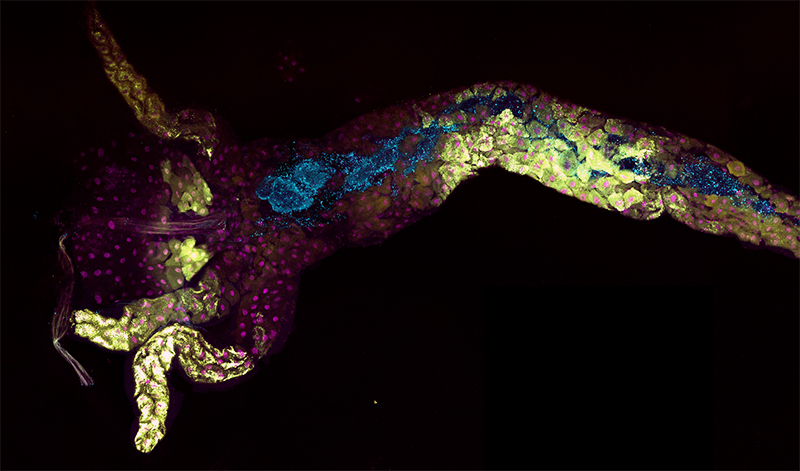
Image par T. Grenier et A. Lambert.
Référence : Intestinal GCN2 controls Drosophila systemic growth in response to Lactiplantibacillus plantarum symbiotic cues encoded by r/tRNA operons. Théodore Grenier, Jessika Consuegra, Mariana G Ferrarini, Houssam Akherraz, Longwei Bai, Yves Dusabyinema, Isabelle Rahioui, Pedro Da Silva, Benjamin Gillet, Sandrine Hughes, Cathy I Ramos, Renata C Matos, François Leulier. eLife, 9 juin 2023.
DOI : 10.7554/eLife.76584
Disciplines
Mots clés






