Publication de l'Institut de Biologie Structurale et du Centre international de recherche en infectiologie, dans la revue Science Advances du 22 août 2018.
Communiqué de presse du CEA.
Une équipe de l'Institut de Biologie Structurale (CEA/CNRS/UGA), en collaboration avec le Centre international de recherche en infectiologie (Inserm/CNRS/ENS de Lyon/UCBL), vient de découvrir une nouvelle interaction entre deux protéines du virus de la rougeole. Dans une région protéique très flexible et dynamique d’une longueur de plus de 300 acides aminés, cette interaction ultra-faible, n’utilisant que quatre acides aminés est pourtant essentielle car la modification de ceux-ci empêche la réplication du virus de la rougeole. Cette zone de la chaîne protéique pourrait constituer une nouvelle cible pour traiter l’infection par la rougeole, voire d’autres virus de la même famille très dangereux pour l’Homme.
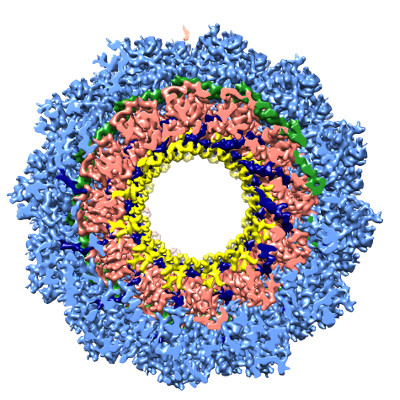
Le génome du virus de la rougeole est couvert par de nombreuses copies d’une ‘nucléoprotéine’ qui forment une très longue structure hélicoïdale protectrice. Cette enveloppe du génome est essentielle pour la réplication virale et est contrôlée par la phosphoprotéine. Cette dernière présente une proportion surprenante de désordre conformationnel, c’est-à-dire sans structure bien définie. Les premiers 300 acides aminés de la phosphoprotéine sont en effet désordonnés et hautement flexibles.
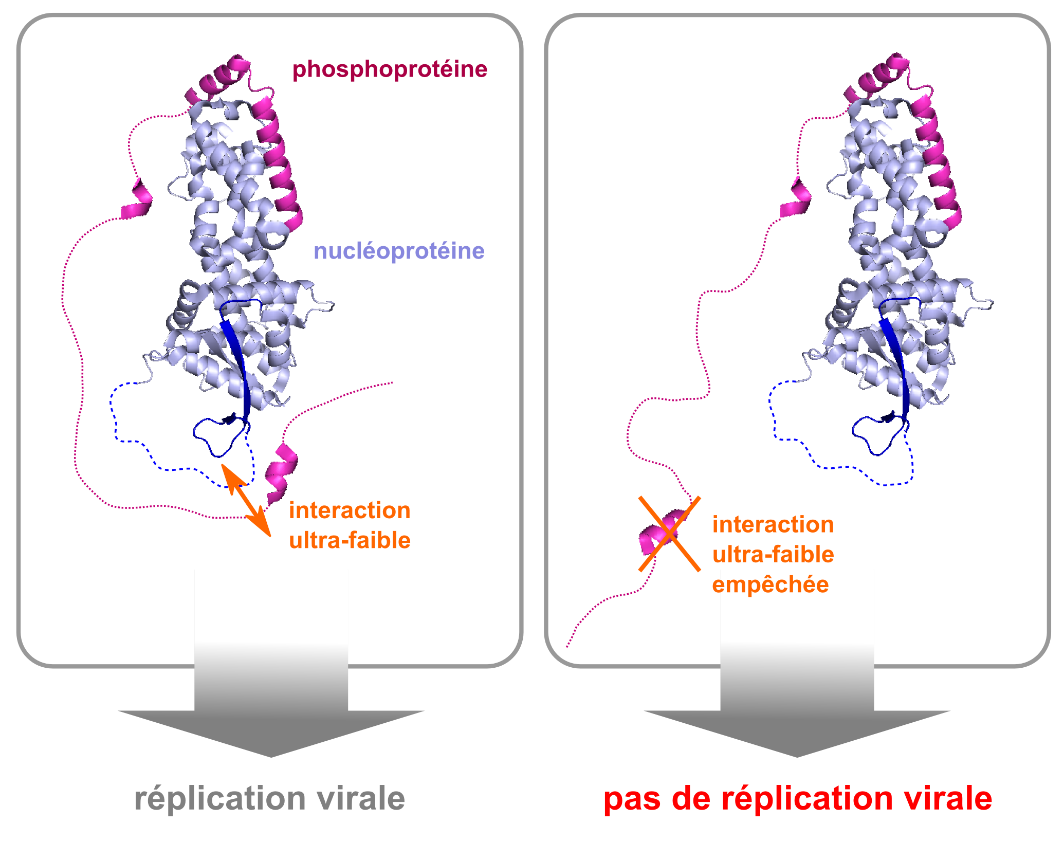
L'utilité de ces domaines désordonnés restait mystérieuse, surtout vue l'utilisation parcimonieuse de l'information génétique de cette famille de virus. Les chercheurs ont utilisé la résonance magnétique nucléaire pour montrer que cette zone de la chaîne d’acides aminés de la phosphoprotéine contient deux sites d'interaction avec la nucléoprotéine aux deux bouts du domaine. Ces deux sites d'interaction agissent ensemble pour garder la molécule dans une forme qui facilite la réplication du virus. En effet, la mutation de seulement quatre acides aminés dans le deuxième site d’interaction, précédemment inconnu et qui constitue un site d’interaction ultra-faible, inhibe la réplication du virus de la rougeole.
"Ce site constitue une nouvelle cible pour traiter l'infection causée par le virus de la rougeole ou d’autres virus humains très dangereux pour la santé", souligne Martin Blackledge, chercheur au CEA et auteur principal de cette étude avec Rob Ruigrok (UGA). Ce mécanisme essentiel semble en effet être conservé chez les Paramyxoviridae, la famille à laquelle appartient le virus de la rougeole [1], mais aussi le virus des oreillons ou le virus de Nipah. "Tous ces virus hébergent ce type de domaines désordonnés et ces observations ouvrent de nouvelles perspectives pour le développement de médicaments contre cette famille d’agents pathogènes", complète M. Blackledge.
Note [1] Les paramyxovirus appartiennent au Groupe V des virus à ARN à simple brin et à polarité négative.
Source : S. Milles, M. R. Jensen, C. Lazert, S. Guseva, S. Ivashchenko, G. Communie, D. Maurin, D. Gerlier, R. W. H. Ruigrok, M. Blackledge, An ultraweak interaction in the intrinsically disordered replication machinery is essential for measles virus function. Sci. Adv. 4, eaat7778 (2018).
Le virus de la rougeole
Le virus de la rougeole appartient à la même famille que le virus de Nipah, qui présent une mortalité au-delà de 70 % chez l’homme. Si son unique réservoir est la personne atteinte de l'infection, même asymptomatique et qu’il est rapidement inactivé par la chaleur ou la lumière ultraviolette et sensible à de nombreux désinfectants, il n’existe pas de traitement antiviral spécifique contre la rougeole. Cette maladie reste extrêmement contagieuse et cause encore chaque année la mort de près de 100 000 personnes, les jeunes enfants non vaccinés étant les plus exposés au risque de complications éventuellement mortelles.
C’est pourquoi l’OMS alertait le 20 août 2018 sur le fait qu’au cours des six premiers mois de 2018, plus de 41 000 adultes et enfants de la Région européenne de l’OMS ont contracté la rougeole, ce qui est déjà plus du double du nombre de cas annuel de ces dernières années.
Disciplines
Mots clés






