Publication du LBMC dans la revue Science, le 9 novembre 2023. Communication du CNRS Biologie du 10 novembre 2023.
Lorsque les spermatozoïdes se forment, ils éliminent les protéines histones, qui empaquètent l’ADN dans toutes nos autres cellules, et les remplacent par des protamines, des protéines spéciales du noyau des spermatozoïdes. Une étude récente, menée par une équipe du LBMC (CNRS/ENS de Lyon) et publiée dans la revue Science, vient mettre pour la première fois en lumière le rôle de cette mécanique, et montre que cette élimination des histones est très importante pour préserver l’identité épigénétique des chromosomes paternels après fécondation.
Dans le noyau des cellules, l’ADN est universellement associé à des protéines histones pour former la chromatine. Cette organisation de l’ADN permet les différentes activités nucléaires, telles que la réplication, la condensation des chromosomes en mitose ou l’expression des gènes. Cependant, chez de nombreuses espèces, les gamètes mâles représentent une exception : au cours du long processus de formation des spermatozoïdes, les histones sont remplacées par des protéines spécifiques de la lignée germinale mâle appelées protamines. S’il est généralement admis que les protamines contribuent à compacter efficacement l’ADN dans le volume restreint des noyaux de spermatozoïdes, le rôle de cette organisation particulière de la chromatine spermatique n'a jamais été testé fonctionnellement et reste très énigmatique.
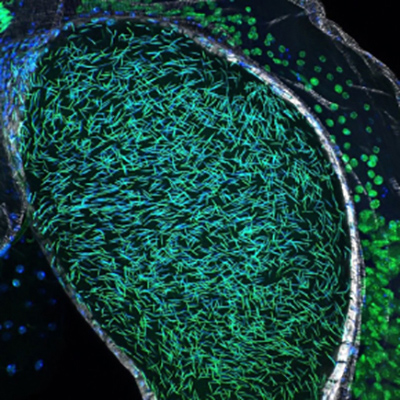
La drosophile représente un modèle de choix pour étudier cette question. La puissance de la génétique de la mouche permet d’identifier efficacement des gènes codant les protéines impliquées dans ces processus de remodelage de la chromatine. De plus, les différentes étapes de la spermatogenèse, et plus particulièrement la transition histone-protamine, sont facilement observables par microscopie confocale, qui utilise généralement le laser comme source de lumière et de nombreux marqueurs fluorescents. Enfin, les femelles de drosophile pondent leurs œufs rapidement après fécondation ce qui permet d’étudier aisément les conséquences d’une modification de l’organisation de la chromatine spermatique sur le développement embryonnaire précoce.
L’élimination des histones pour protéger l’identité épigénétique des chromosomes paternels
Grâce à l’étude d’un mutant appelé paternal loss (pal), isolé dans un crible génétique au début des années 70, les scientifiques ont découvert de façon inattendue que l’enlèvement des histones de la chromatine des spermatozoïdes n’est pas essentiel pour la spermatogenèse mais est en revanche critique pour protéger les chromosomes paternels après fécondation. Les scientifiques montrent que dans le mutant pal, les histones sont anormalement retenues dans le noyau des spermatozoïdes. Ces noyaux qui présentent une forme caractéristique en aiguille sont raccourcis d’un tiers de leur longueur et sont également plus épais. Ce changement de la morphologie des noyaux n’a pas de conséquences notables sur la capacité des spermatozoïdes à pénétrer dans l’œuf. Cependant, après fécondation les chromosomes paternels des mutants pal sont anormalement reconnus par les protéines de l’œuf qui contrôlent la division méiotique des chromosomes maternels. Les chromosomes paternels se comportent alors comme des chromosomes maternels et s’engagent dans une division méiotique aberrante qui entraine la fragmentation du pronoyau paternel et la perte de chromosomes au début du développement de l’embryon.
Cette étude démontre pour la première fois une fonction fondamentale de l’élimination des histones du noyau du spermatozoïde chez la drosophile : déterminer et protéger l’identité épigénétique des chromosomes paternels après fécondation. Cette découverte change en profondeur notre compréhension de la transition histone-protamine qui existe chez de nombreuses espèces, dont l’Homme. Enfin, l’analyse de ce mutant remarquable met en évidence l’extraordinaire plasticité de la chromatine spermatique chez les insectes.
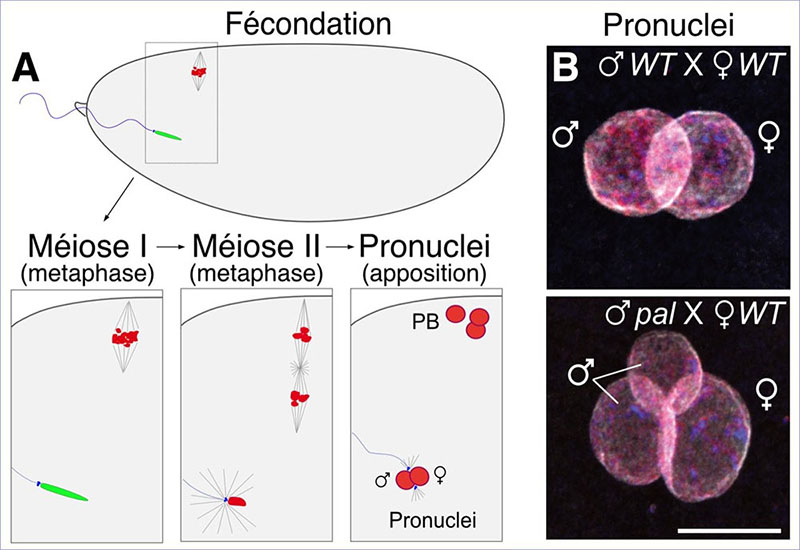
(A) Schéma présentant les premières étapes après fécondation chez la drosophile. Lorsque le spermatozoïde pénètre dans l’œuf, la méiose femelle alors bloquée en métaphase de méiose I reprend. Le noyau du spermatozoïde se décondense : les protamines (vert) sont remplacées par les histones (rouge). Après méiose, le noyau femelle migre et s’appose au noyau mâle. (B) Images de microscopie dans un embryon marqué pour les histones (rouges), l’ADN (bleu) et la Lamine (blanc), qui forme l’enveloppe nucléaire. Haut : apposition des pronuclei mâle et femelle dans un embryon contrôle (WT). Bas : apposition des pronuclei dans un œuf fécondé par un mutant pal. Le noyau paternel est fragmenté.
Figure et illustration : © Raphaëlle Dubruille, Benjamin Loppin
Référence
Histone removal in sperm protects paternal chromosomes from premature division at fertilization. Raphaëlle Dubruille, Marion Herbette, Maxime Revel, Béatrice Horard, Ching-Ho Chang et Benjamin Loppin. Science, 9 novembre 2023.
DOI : 10.1126/science.adh0037
Disciplines
Mots clés